Die Entwicklung von Schmerzmitteln ohne Nebenwirkungen
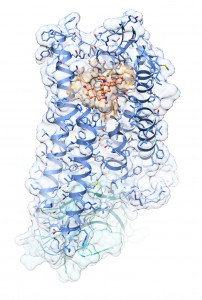
Kristallstruktur des μ-Opioidrezeptor-Agonist-Komplexes im Aktivzustand (orange: Agonist BU72; blau: μ-Opioidrezeptor; türkis: G-Protein imitierender Nanobody). Grafik: Ralf Kling, FAU
Für den Laien sieht es aus wie eine Wolke, in der blaue Girlanden und geknickte Strohhalme schweben. Für den Experten könnte die Darstellung der Kristallstruktur des aktivierten μ-Opioidrezeptors, der zur Klasse der G-Protein gekoppelten Rezeptoren gehört, ein maßgeblicher Schritt hin zu starken Schmerzmitteln sein, die einerseits höchst effektiv wirken und andererseits so gut wie frei von Nebenwirkungen sind. Ein internationales Forscherteam, an dem pharmazeutische Chemiker der Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) beteiligt sind, hat die dreidimensionale Molekülstruktur in der aktuellen Ausgabe der Fachzeitschrift Nature veröffentlicht. Das Ziel der Arbeitsgruppe, die vom Nobelpreisträger und Stanfordprofessor Brian Kobilka geleitet wird, ist es, zukünftig Wirkstoffe zu entwickeln, die passgenau diesen Rezeptor aktivieren.
Bereits seit Jahrtausenden gehören die Opiate zu den wichtigsten Heilmitteln. Sie werden zur Linderung schwerer und schwerster Schmerzen eingesetzt und sind deshalb für die Gesellschaft von unschätzbarem Wert. Wegen ihrer euphorisierenden und Abhängigkeit erzeugenden Wirkung zeigen Opiate, zu denen auch das Heroin gehört, jedoch auch verheerende Auswirkungen und können im Fall einer Überdosierung zum Tod durch Atemstillstand führen. Trotz intensiver Forschung ist es bisher nicht gelungen, die Suchtwirkung der Opiate von den segensreichen schmerzstillenden Eigenschaften abzutrennen. So ist die Entwicklung nebenwirkungsfreier Schmerzmittel nach wie vor ein wichtiges Ziel der Pharmaforschung.
Seit einigen Jahren setzen Wissenschaftler ihre Hoffnungen auf das so genannte strukturbasierte Design von Medikamenten. Dabei muss zuerst die genaue Struktur des Rezeptors bekannt sein, um dann einen Wirkstoff herstellen zu können, der wie ein Puzzleteil am Rezeptor andockt. Dem internationalen Forscherteam, an dem Prof. Dr. Peter Gmeiner und Dr. Ralf Kling, Lehrstuhl für Pharmazeutische Chemie, mitarbeiten, ist es nun gelungen, die Kristallstruktur des μ-Opioidrezeptors – dem wichtigsten Angriffspunkt für starke Schmerzmittel auf Opiatbasis – dreidimensional darzustellen. Die gerade in der Zeitschrift Nature publizierte hochaufgelöste Kristallstruktur des μ-Opioidrezeptors gibt Anlass zu neuer Hoffnung für die Entwicklung effektiver und sicherer Schmerzmittel der Zukunft.
Ein detailliertes molekulares Verständnis der Wechselwirkung zwischen Wirkstoff und Rezeptor wird als Ausgangspunkt für das strukturbasierte Design neuartiger Schmerzmittel überaus wertvoll sein. Diese sollen schmerzhemmende Signale erzeugen, die vom Rezeptor durch die Aktivierung des sogenannten G-Proteins ausgehen. Dagegen sollen Reize, die über die Bindung des Proteins β-Arrestin vermittelt werden, blockiert werden. Wirkstoffe dieser Art, die auch „biased ligands“ genannt werden, sind funktionell selektiv, da sie die gewünschte Wirkung auslösen ohne eine Nebenwirkung herbeizuführen.
Pressestelle der Friedrich-Alexander-Universität Erlangen-Nürnberg, 05.08.2015
